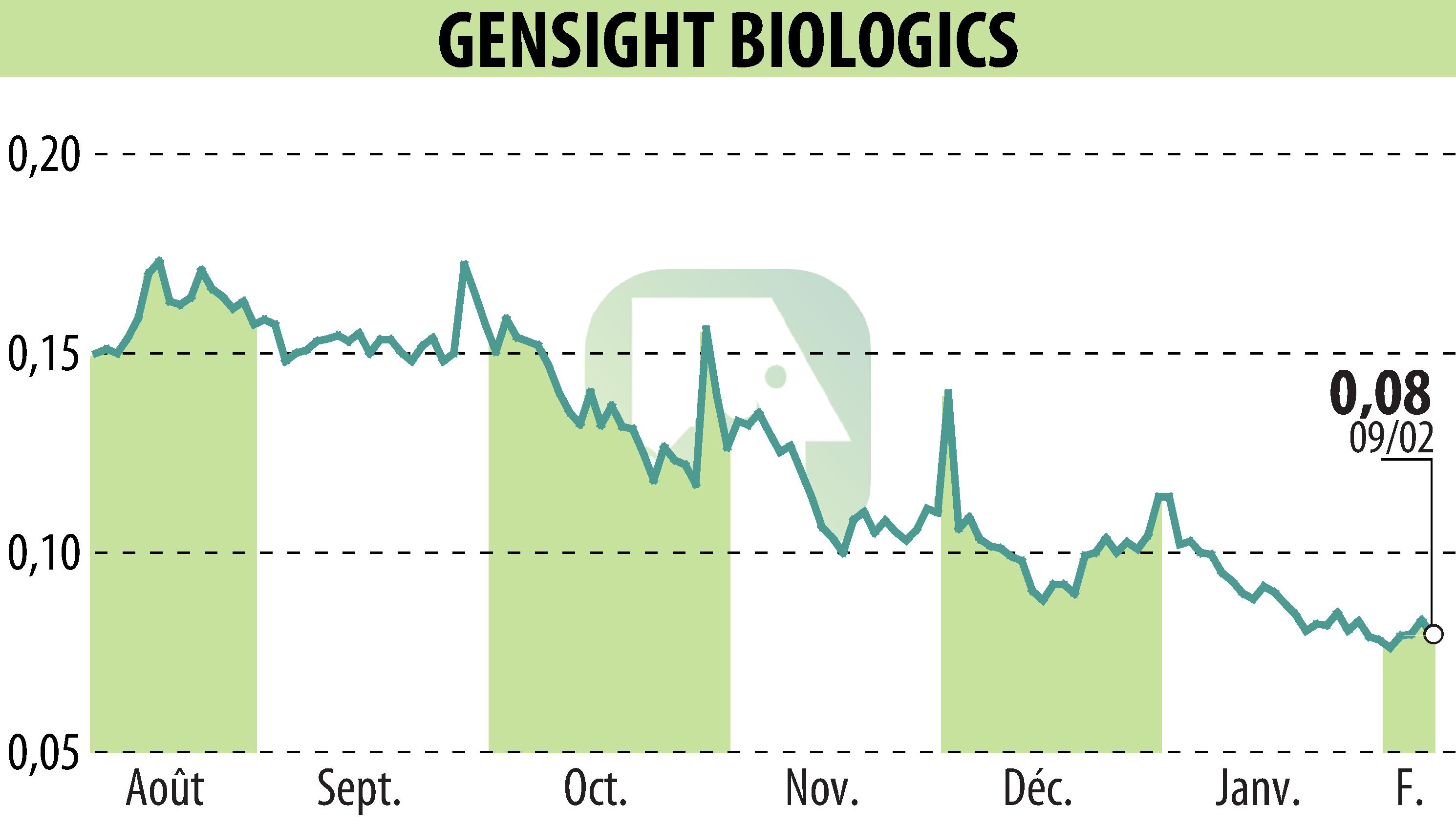
on GENSIGHT BIOLOGICS S.A. (EPA:SIGHT)
GenSight Biologics lance l'étude REVISE pour le traitement GS010
L’hôpital national 15-20 de Paris et la société biopharmaceutique GenSight Biologics ont initié le traitement du premier patient dans le cadre de l’étude GS010/LUMEVOQ® REVISE. Approuvée par l’ANSM (Agence nationale de sécurité du médicament et des produits de santé), cette étude d’évaluation de la dose inclura 14 patients. Elle contribue aux efforts déployés pour développer des traitements novateurs contre les maladies rares telles que la neuropathie optique héréditaire de Leber (LHON).
L’Hôpital national 15-20 est actuellement le seul établissement européen à mener des études cliniques avec le GS010, un candidat de thérapie génique destiné au traitement de la neuropathie optique héréditaire de Leber (LHON) causée par des mutations du gène mitochondrial ND4. Le lancement de cette étude témoigne de l’engagement de l’hôpital envers les avancées scientifiques majeures. L’ANSM (Agence nationale de sécurité du médicament et des produits de santé) a autorisé l’étude REVISE et un programme d’accès précoce en décembre 2025.
Le GS010 n'a pas encore reçu d'autorisation de mise sur le marché. Cependant, son développement clinique progresse, soulignant l'urgence de répondre aux besoins médicaux non satisfaits des patients atteints de LHON.
R. H.
Copyright © 2026 FinanzWire, all reproduction and representation rights reserved.
Disclaimer: although drawn from the best sources, the information and analyzes disseminated by FinanzWire are provided for informational purposes only and in no way constitute an incentive to take a position on the financial markets.
Click here to consult the press release on which this article is based
See all GENSIGHT BIOLOGICS S.A. news
