on Nanohale AG (ETR:FYB)
Le biosimilaire Lucentis® FYB201/Ranivisio® obtient l'approbation au Brésil
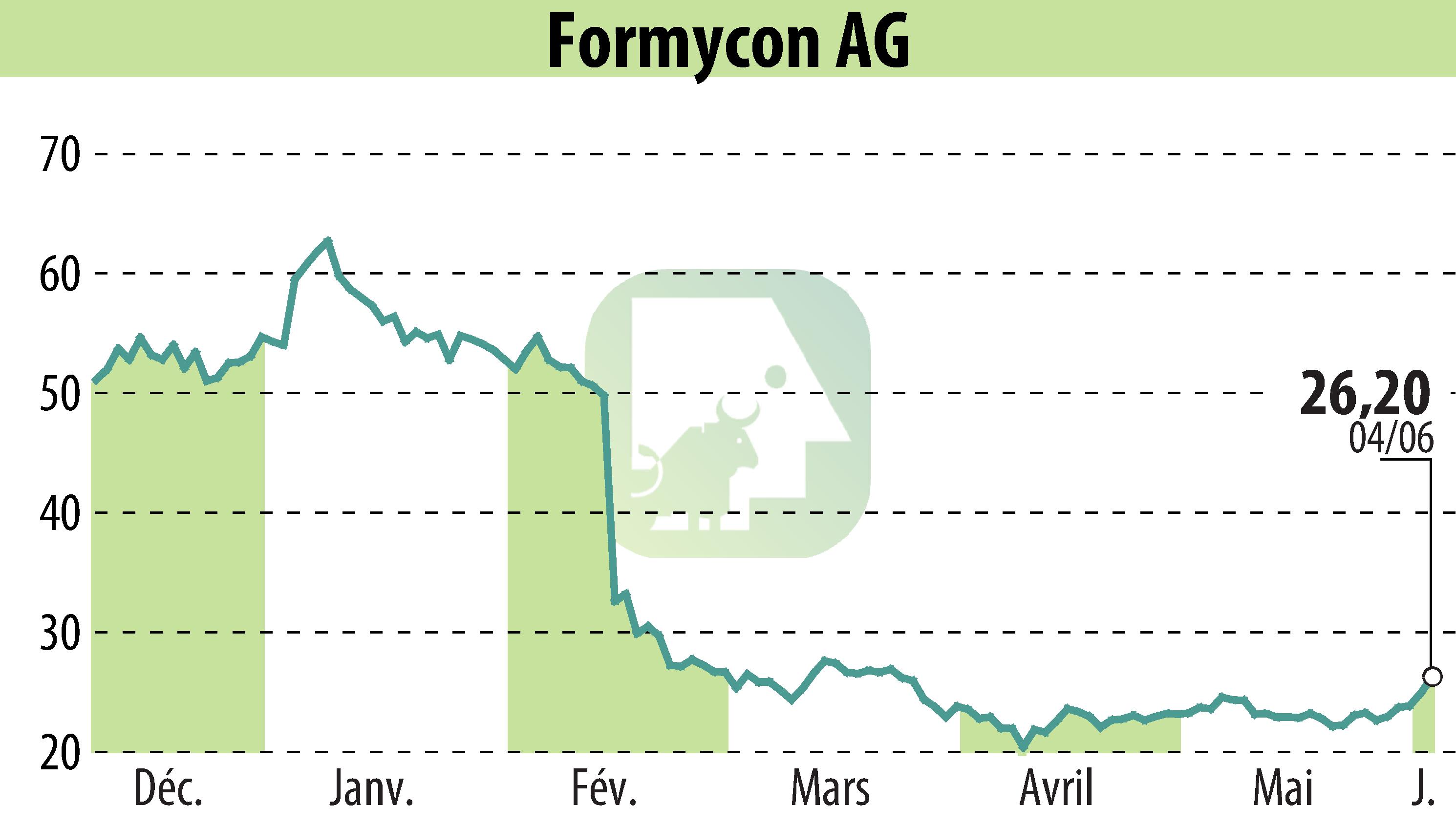
Formycon AG, Allemagne, a annoncé que le biosimilaire FYB201/Ranivisio®, équivalent de Lucentis® (ranibizumab), a reçu l'autorisation de mise sur le marché de l'ANVISA, l'autorité réglementaire brésilienne. Ranivisio® est le premier biosimilaire de Lucentis® approuvé au Brésil. Son lancement est prévu au quatrième trimestre 2025 en partenariat avec Biomm, une société pharmaceutique brésilienne, marquant ainsi le début de son déploiement en Amérique latine.
Les autorisations de mise sur le marché ont déjà été obtenues au Pérou, au Salvador, au Honduras et en République dominicaine. D'autres lancements en Amérique centrale et en Amérique du Sud sont prévus d'ici début 2027. Biomm, bien implanté sur le marché brésilien de la santé, s'appuiera sur son expertise locale pour dynamiser la commercialisation. Le marché brésilien des thérapies anti-VEGF est évalué à 374 millions de réaux brésiliens par an.
FYB201/Ranivisio® cible les maladies rétiniennes sévères. Développé par Bioeq AG, une collaboration entre Formycon et Polpharma Biologics Group, ce biosimilaire est disponible dans 21 pays, dont des régions d'Europe, d'Amérique du Nord et du Moyen-Orient et d'Afrique du Nord.
R. E.
Copyright © 2026 FinanzWire, all reproduction and representation rights reserved.
Disclaimer: although drawn from the best sources, the information and analyzes disseminated by FinanzWire are provided for informational purposes only and in no way constitute an incentive to take a position on the financial markets.
Click here to consult the press release on which this article is based
See all Nanohale AG news
